Publicada na Nature Communications, pesquisa abre novos caminhos para desenho racional de enzimas e sugere que outras moléculas atuem de forma similar
Até pouco tempo, eram comuns afirmações de que enzimas da classe das hidrolases glicosídicas atuavam sempre a partir apenas de um determinado “itinerário conformacional” durante o ciclo catalítico. No entanto, trabalho desenvolvido por pesquisadores do Laboratório Nacional de Biorrenováveis (LNBR), que integra Centro Nacional de Pesquisa em Energia e Materiais (CNPEM) e publicado na revista Nature Communications revelou que enzimas ativas sobre a hemicelulose, centrais para valorização de resíduos agroindustriais, são capazes de clivar ligações glicosídicas por duas rotas catalíticas, algo inesperado em biocatálise de carboidratos. Essa descoberta abre novos horizontes a respeito do funcionamento molecular de uma classe de enzimas de grande relevância industrial e traz impactos imediatos no desenvolvimento teórico na área da biocatálise.
A enzima relatada neste artigo é peça-chave no desenvolvimento de biocombustíveis e bioprodutos, já que se trata de uma proteína com potencial para aumentar a obtenção de açúcares a partir de resíduos industriais. Essa característica, avaliam os pesquisadores, é essencial para a indústria de biorrenováveis que está continuamente em busca de processos que aliem eficiência na obtenção de açúcar e rapidez na conversão em produtos de alto valor agregado e baixa pegada de carbono.
Mas, se as coisas ainda parecem um pouco confusas, vamos esclarecer. Itinerário catalítico, no jargão científico, representa as modificações químicas e estruturais que o substrato sofre pela ação da enzima até que este seja clivado e um produto seja formado. Esse conjunto de modificações químicas e estruturais, chamado aqui de itinerário catalítico, era considerado único para uma dada enzima e seu substrato – molécula, neste caso carboidrato, que será reconhecido pela enzima e então clivado (convertido em produtos). O trabalho do LNBR/CNPEM quebra este paradigma e demonstra por cálculos quânticos e por experimentos em super resolução que algumas enzimas de grande importância industrial podem funcionar por itinerário catalíticos alternativos e viáveis no ponto de vista termodinâmico.
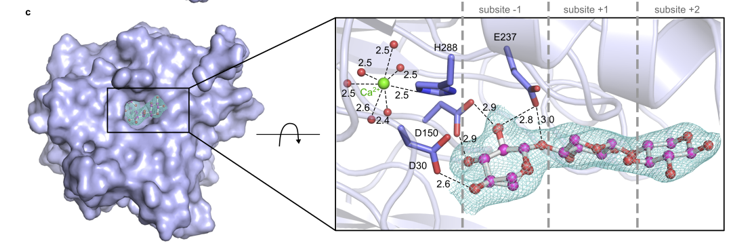 Estrutura cristalográfica revela enzima momentos antes de sua atuação no substrato; detalhe na enzima (em roxo) se refere ao sítio ativo, exatamente onde o substrato se liga (LNBR/CNPEM)
Estrutura cristalográfica revela enzima momentos antes de sua atuação no substrato; detalhe na enzima (em roxo) se refere ao sítio ativo, exatamente onde o substrato se liga (LNBR/CNPEM)
“Esses resultados, além de modificar nosso entendimento no campo teórico da biocatálise de carboidratos, elevam nossa capacidade de racionalmente engenheirar enzimas visando aplicações biotecnológicas”, esclarece Mario Murakami, Diretor Científico do LNBR/CNPEM e líder deste estudo.
Na prática, o estudo permitirá que outros pesquisadores encontrem formas para redesenhar o sítio ativo – região da enzima responsável por ligar e converter o substrato em um produto – bem como para criar moléculas análogas ao substrato capazes de inibir ações de determinadas enzimas. Isso é especialmente importante em inúmeras aplicações que vão da produção industrial de químicos biorrenováveis (aqueles obtidos a partir de plantas), até à área da saúde. “Pensemos em um profissional trabalhando com uma célula. Durante esse trabalho, o pesquisador identifica uma atividade enzimática que precisa ser inibida (desativada). A partir do conhecimento obtido com o desenho racional é possível criar este inibidor customizado”, explica Mariana Morais, pesquisadora do LNBR/CNPEM e autora principal do estudo.
Para esse estudo, os cientistas utilizaram o estado da arte em instrumentação Síncrotron do Laboratório Nacional de Luz Síncrotron (LNLS/CNPEM) para a cristalografia de raios X, enquanto as simulações computacionais baseadas em cálculos quânticos foram realizadas na rede espanhola de supercomputadores e na Universidade de Barcelona. Os demais experimentos foram feitos nas instalações do LNBR e do LNBio. O trabalho foi realizado com auxílios FAPESP (2015/26982-0, 2016/19995-0 e 2018/22138-8) e CNPq (306135/2016-7), além de agências financiadoras da Europa.
Sobre o CNPEM
O Centro Nacional de Pesquisa em Energia e Materiais (CNPEM) é uma organização social supervisionada pelo Ministério da Ciência, Tecnologia e Inovações (MCTI). Localizado em Campinas-SP, gerencia quatro Laboratórios Nacionais – referências mundiais e abertos às comunidades científica e empresarial. O Laboratório Nacional de Luz Síncrotron (LNLS) está, nesse momento, finalizando a montagem do Sirius, o novo acelerador de elétrons brasileiro; o Laboratório Nacional de Biociências (LNBio) atua na área de biotecnologia com foco na descoberta e desenvolvimento de novos fármacos; o Laboratório Nacional de Biorrenováveis (LNBR) pesquisa soluções biotecnológicas para o desenvolvimento sustentável de biocombustíveis avançados, bioquímicos e biomateriais, empregando a biomassa e a biodiversidade brasileira; e o Laboratório Nacional de Nanotecnologia (LNNano) realiza pesquisas científicas e desenvolvimentos tecnológicos em busca de soluções baseadas em nanotecnologia. Os quatro Laboratórios têm, ainda, projetos próprios de pesquisa e participam da agenda transversal de investigação coordenada pelo CNPEM, que articula instalações e competências científicas em torno de temas estratégicos.
Sobre o LNBR
O Laboratório Nacional de Biorrenováveis (LNBR) integra o Centro Nacional de Pesquisa em Energia e Materiais (CNPEM), organização social qualificada pelo Ministério da Ciência, Tecnologia e Inovações (MCTI). O LNBR emprega a biomassa e a biodiversidade brasileiras para resolver desafios relevantes para o País por meio de soluções biotecnológicas que promovam o desenvolvimento sustentável de biocombustíveis avançados, bioquímicos e biomateriais. O Laboratório possui diversas Instalações Abertas a Usuários, incluindo uma Planta Piloto para desenvolvimento de processos industriais sustentáveis, estrutura singular no país para escalonamento de tecnologias.
CONTACT US
Press Inquiries
Erik N. Medina
+55 19 3518-3138
erik.medina@lnbr.cnpem.br